Une étude exclusive pour :
- Présenter les processus d’accès au marché depuis le pré-AMM jusqu’à l’étape de prix et remboursement pour les cinq grands marchés d’Europe : France, Allemagne, Espagne, Italie et Royaume-Uni,
- Mettre en exergue, dans chaque pays, les mécanismes permettant d’anticiper, de faciliter ou d’accélérer la mise sur le marché et le remboursement des innovations pharmaceutiques,
- Disposer d’une analyse comparative des piliers de l’accès au marché sur ces 5 marchés,
- Identifier les évolutions attendues de l’accès au marché dans ces pays européens.
L’accès au marché des médicaments en Europe
Cette étude vise à présenter les processus de Market Access des médicaments dans les cinq plus grands marchés d’Europe (France, Allemagne, Espagne, Italie et Royaume-Uni), avec une attention particulière portée à l’accès au marché des innovations thérapeutiques.
Depuis le début de la décennie, les lancements de ces innovations se sont en effet accélérés, et entre 2012 et 2014, le nombre de nouvelles molécules mises sur le marché chaque année a doublé au sein de l’Union européenne (14 en 2012 et 28 en 2014).
Afin d’offrir aux patients un accès rapide aux innovations thérapeutiques, tout en permettant aux systèmes de santé de s’adapter aux nouveaux enjeux qu’elles représentent en termes d’évaluation et d’impact budgétaire, les autorités de santé européennes se sont dotées de dispositifs ayant pour objectif de favoriser ou accélérer l’accès au marché de ces innovations.
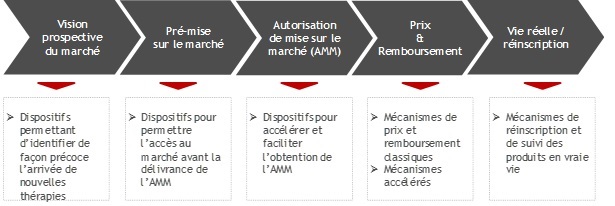
Pour chaque pays étudié, le processus d’accès au marché a été analysé selon ces 5 grandes étapes
Les consultants de Care Factory, auteurs de l‘étude
Daniel Szeftel, directeur de Care Factory
Daniel travaille depuis plus de 15 ans sur les questions d’économie de la santé et d’amélioration des parcours de soins. Il intervient sur les questions d’innovation et de santé à l’école des Mines, à Sciences-Po et en Faculté de pharmacie. Depuis 2003, il a eu l’occasion d’accompagner sur des études d’accès au marché ou de gestion de l’innovation l’ensemble des acteurs du système de santé : assurance maladie, agences régionales de santé, assureurs privés, laboratoires pharmaceutiques, professionnels et établissements de santé, fournisseurs de dispositifs médicaux, prestataires de santé à domicile et associations de patients.
Laure de Limerville, consultante sénior au sein de Care Factory
Consultante avec 6 ans d’expérience dans le secteur de la santé, Laure mène de nombreux projets de Market Access et d’affaires publiques pour les industriels du médicament et du dispositif médical. Elle dispose également d’une forte expertise dans la conception et la mise en œuvre de programmes patients.
|
|
ContactUne question? Nous sommes là pour vous aider!
JE REMPLIS LE FORMULAIRE POUR ETRE CONTACTE PAR UN CONSEILLER
|

NOTRE CONSULTANT
FICHE TECHNIQUE
TARIF
A partir de 3350 € H.T
Rédigée en français
Novembre 2018
250 pages
NEWSLETTER
Benchmark des cinq premiers marchés européens
1. Synthèse opérationnelle
- Les enseignements clés de l’étude
2. Le cadre d’analyse des conditions de Market Access en Europe
- L’évolution de l’accès au marché depuis les années 1980
- Une tendance à la centralisation au niveau européen
- L’AMM : les procédures classiques et les dispositifs pour faciliter et accélérer l’accès au marché : les adaptative pathways et le projet PRIME
- Les procédures d’évaluation HTA au niveau européen : le rôle de EUnetHTA
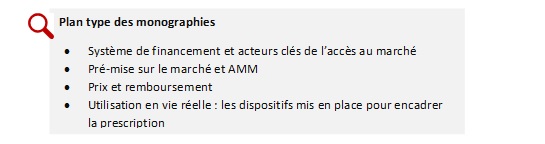
3. Monographies détaillées des 5 pays étudiés
- Allemagne
- Espagne
- France
- Italie
- Royaume-Uni
4. Analyse transversale des conditions d’accès au marché dans les 5 pays du benchmark
Cartographie de l’accès au marché dans les 5 pays faisant l’objet de ce benchmark, à partir d’une dizaine de critères clés liés aux facteurs suivants :
- Estimation des délais d’accès au marché
- Place de la pharmaco-économie
- Modalités de fixation des prix
- Mesures spécifiques destinées à favoriser les innovations thérapeutiques
- Modalités de financement en milieu hospitalier
5. Les perspectives d’évolution des conditions d’accès au marché
- Les enjeux clés auxquels sont confrontés ces 5 pays
- Les perspectives d’évolution de l’évaluation « HTA » au niveau européen
- Le rôle croissant des données de vie réelle
|
|
ContactUne question? Nous sommes là pour vous aider!
JE REMPLIS LE FORMULAIRE POUR ETRE CONTACTE PAR UN CONSEILLER
|

NOTRE CONSULTANT
FICHE TECHNIQUE
TARIF
A partir de 3350 € H.T
Rédigée en français
Novembre 2018
250 pages
NEWSLETTER
Réalisée en partenariat avec le cabinet de conseil

|
|
ContactUne question? Nous sommes là pour vous aider!
JE REMPLIS LE FORMULAIRE POUR ETRE CONTACTE PAR UN CONSEILLER
|

NOTRE CONSULTANT
FICHE TECHNIQUE
TARIF
A partir de 3350 € H.T
Rédigée en français
Novembre 2018
250 pages
NEWSLETTER